Анализ несоответствий систем фармаконадзора держателей регистрационных удостоверений лекарственных средств, зарегистрированных в Казахстане, требованиям GVP
01.03.2023О результатах инспекций системы фармаконадзора держателей регистрационных удостоверений лекарственных средств, зарегистрированных в Казахстане, требованиям GVP, рассказала руководитель управления системы фармаконадзора и мониторинга безопасности, эффективности и качества медицинских изделий департамента инспекций, доктор медицинских наук, MBA Алия Табаева
В 2022 году Национальный центр экспертизы лекарственных средств и медицинских изделий провел 15 плановых и внеплановых инспекций держателей регистрационных удостоверений зарегистрированных в Республике Казахстан лекарственных средств на определение соответствия системы фармаконадзора требованиям GVP.
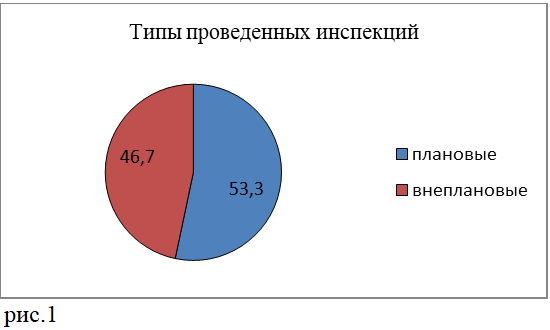
Плановые инспекции выполнялись на основе риск-ориентированного подхода. Основанием для проведения внеплановых инспекций явилось наличие инициирующих факторов, таких как:
- невыполнение обязательств по фармаконадзору, обозначенных приказом Министерства здравоохранения РК от 23 декабря 2020 года №ҚР ДСМ-320/2020 «Об утверждении правил проведения фармаконадзора и мониторинга безопасности, качества и эффективности медицинских изделий» по проведению оценки соотношения «польза-риск» лекарственных средств, имеющих бессрочное регистрационное удостоверение;
- информация о несоблюдении обязательств по обеспечению безопасности лекарственного препарата, полученная из других источников.
По результатам проведенных инспекций у держателей регистрационных удостоверений был выявлен ряд несоответствий требованиям GVP, которые были квалифицированы как критические, существенные и несущественные. согласно общепринятой классификации несоответствий. Всего идентифицировано 166 несоответствий.
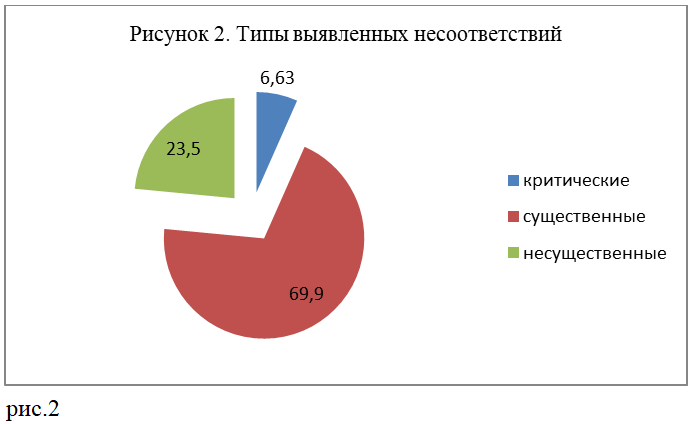
Критические несоответствия
В ходе инспекции критические несоответствия выявлены у 5 (33,3 %) держателей регистрационных удостоверений. К 11 случаям критическим несоответствий отнесены значительные либо системные несоответствия, обнаруженные при инспектировании процедур и показателей ниже перечисленных критических процессов фармаконадзора, отрицательно влияющие на всю систему фармаконадзора, права, безопасность и благополучие пациентов и представляющие серьезное нарушение действующих требований законодательства Республики Казахстан:
- непрерывный мониторинг профиля безопасности и соотношения польза-риск зарегистрированных лекарственных препаратов;
- внедрение, реализация и оценка системы управления рисками с оценкой эффективности мер минимизации риска;
- процедуры работы с индивидуальными сообщениями о нежелательных реакциях: сбор, обработка, управление, контроль качества, получение недостающих данных, присвоение номера, классификация, выявление повторных сообщений, оценка и своевременное представление;
- выявление, изучение и оценка сигналов;
- разработка, подготовка (включая оценку данных и контроль качества), представление и оценка периодических отчетов по безопасности;
- обеспечение поддержания информации по лекарственному препарату, включая инструкцию по медицинскому применению, в соответствии с современным уровнем научных медицинских знаний, включая сделанные заключения по оценке и рекомендации уполномоченного органа.
Существенные несоответствия
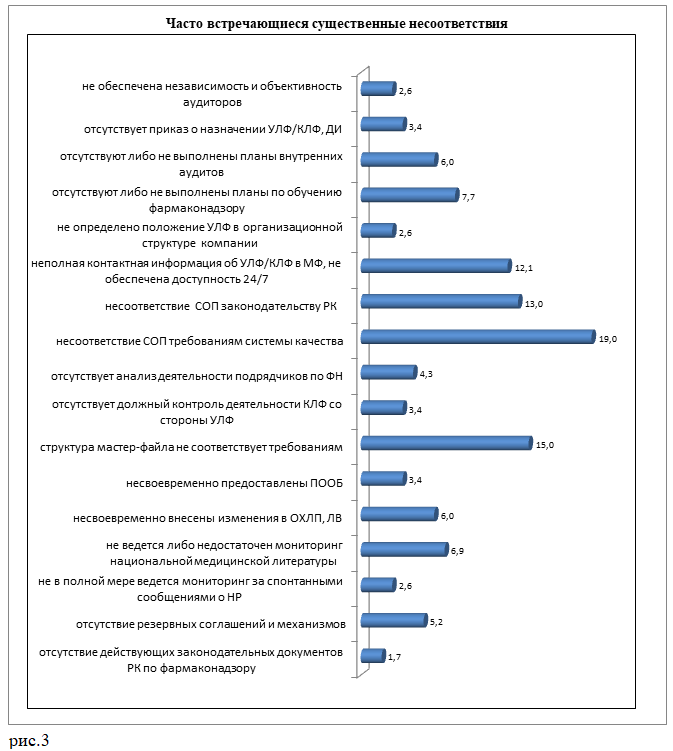
Существенные несоответствия выявлены у всех держателей регистрационных удостоверений, где прошли инспекции. К ним отнесены наиболее часто встречающиеся несоответствия по структуре и содержанию мастер-файла системы фармаконадзора держателя регудостоверений и системе качества фармаконадзора, которые потенциально сказывались на правах, безопасности и благополучии пациентов, и являлись нарушением действующих требований законодательства Республики Казахстан по фармаконадзору.
Помимо перечисленных, часто встречающихся несоответствий, выявлены:
- отсутствие договорных соглашений между несколькими держателями регистрационных удостоверений о совместном ведении системы фармаконадзора;
- несвоевременное предоставление в экспертную организацию уведомления о смене уполномоченного лица, ответственного за фармаконадзор;
- недостаточность необходимых средств и оборудования для процесса;
- отсутствие обеспечения сохранности данных по фармаконадзору в течение установленного периода;
- отсутствие процедуры по валидации компьютеризированных систем;
- ограниченный поиск сообщений о нежелательных реакциях при мониторинге национальной научно-медицинской литературы (только по МНН и узкому перечню медицинских изданий);
- непредоставление информации по работе с медицинскими запросами;
- использование неактуальной версии MedDRA;
- несоответствие структуры периодического отчета по безопасности лекарственных средств;
- формальный подход к обучению контактных лиц по фармаконадзору;
- неэффективное взаимодействие уполномоченного лица, ответственного за глобальный фармаконадзор, с контактным лицом по фармаконадзору в Казахстане.
Несущественные несоответствия
Несущественные несоответствия отмечались у подавляющего большинства держателей регудостоверений (93,3 %) и встречались в виде ненадлежащего оформления отдельных процедур и документов, некоторых упущений в содержании стандартных операционных процедур, руководств и инструкций, планов, отчетов, а также в техническом несоответствии требованиям, установленным системой качества и/или законодательством.
Подводя итоги проведенных инспекций, Национальный центр обрашает внимание держателей регистрационных удостоверений на следующие аспекты работы с уполномоченными/контактными лицами, ответственными за фармаконадзор в Казахстане, которые требуют тесного взаимодействия и регулярного контроля качества со стороны глобального офиса:
- знание основ действующего законодательства Республики Казахстан по фармаконадзору;
- профессиональный отбор уполномоченных/контактных лиц по фармаконадзору с учетом теоретических знаний и практического опыта по ведению деятельности по фармаконадзору с проведением оценки посредством предварительного аудита;
- обучение уполномоченных/контактных лиц в области своей системы фармаконадзора держателем регистрационного удостоверения до его официального назначения и последующее регулярное обучение;
- обеспечение круглосуточного доступа уполномоченных/контактных лиц путем оснащения его специально выделенными доступным для казахстанцев (с казахстанским кодом) номером телефона с автоматической записью и регистрацией звонков и электронной почтой для приема сообщений о нежелательных реакциях с указанием названия компании;
- утверждение перечня национальных медицинских изданий и сайтов для мониторинга сообщений о нежелательных реакциях на лекарственные средства, контроль качества результатов поиска;
- контроль своевременности и эффективности взаимодействия уполномоченных/контактных лиц с уполномоченным органом по предоставлению отчетов о нежелательных реакциях, периодических обновляемых отчетов по безопасности, плана управления рисками, уведомлений о смене уполномоченного лица, внесений изменений в общей характеристике лекарственного препарата и листка-вкладыша, а также других документов по оценке безопасности лекарственных средств;
- аудит уполномоченных/контактных лиц на регулярной основе.
Выполнение держателями регистрационных удостоверений своих обязательств, установленных законодательством Республики Казахстан, будет способствовать безопасности и эффективности применения лекарственных препаратов, реализуемых в стране, соблюдению прав и благополучия пациентов.


