Формаконадзор и мониторинг безопасности лекарственных средств в Республике Казахстан.
03.05.2013
 Фармаконадзор (ФН) – государственная система сбора и научной оценки информации о побочных реакциях на лекарственные средства при их медицинском применении с целью принятия соответствующих регуляторных мер по их предупреждению. Лекарственная безопасность не означает отказ от лечения препара том, это умелое и разумное применение лекарственных средств. Особенно ответственно врачу необходимо подходить к назначению лекарственных препаратов детям, пожилым людям, беременным и кормящим женщинам.
Фармаконадзор (ФН) – государственная система сбора и научной оценки информации о побочных реакциях на лекарственные средства при их медицинском применении с целью принятия соответствующих регуляторных мер по их предупреждению. Лекарственная безопасность не означает отказ от лечения препара том, это умелое и разумное применение лекарственных средств. Особенно ответственно врачу необходимо подходить к назначению лекарственных препаратов детям, пожилым людям, беременным и кормящим женщинам.
За последние годы фармаконадзор в процессе развития превратился в специальную научную дисциплину во всем мире, имеющую свои научные принципы и методологию, национальные и международные центры, научные общества, специальные журналы и веб-сайты (1). Поэтому цели и задачи ФН значительно расширились, и сегодня мировым сообществом рассматривается множество вопросов, направленных на повышение эффективности мониторинга безопасности лекарственных средств. Об этом свидетельствуют и изменения в законодательстве ФН Евросоюза. В соответствии с Директивами ЕС 2010/84/ЕС (дата утверждения – 2 июля 2012 г.) и Постановлением Еврокомиссии №520/2012 (дата вступления в силу – 10 июля 2012 г.) в рамках фармаконадзора предусмотрено создание нового органа Комитета по оценке рисков, а также впервые внедряется Надлежащая практика фармаконадзора (GVP Good Pharmacovigilance practice). Надлежащая практика фармаконадзора представляет собой комплекс мер, составленных в целях содействия выполнению мониторинга безопасности лекарственных средств как владельцам регистрационного удостоверения, так и контрольно-разрешитель ным органам (http://www.ema.europa.eu). Следует также отметить, что при мониторинге безопасности ЛС необходимо уделить особое внимание и следующим вопросам:
• применение лекарственных препаратов не по показаниям;
• медицинские ошибки при применении лекарственных препаратов;
• применение некачественных и фальсифицированных лекарственных препаратов;
• острые и хронические отравления;
• смертность, вызванная лекарственными препаратами;
• злоупотребление лекарственными препаратами;
• взаимодействие между лекарственными препаратами и др.
Для решения всех указанных проблем необходимо:
• укрепление кадровых ресурсов и научно-технической базы Службы ФН нашей страны;
• осуществление активного обмена информацией
между национальными центрами ФН и международным центром ВОЗ;
• разработка и широкое внедрение образовательных и информационных программ для медицинской,
фармацевтической общественности;
• повышение осведомлённости населения.
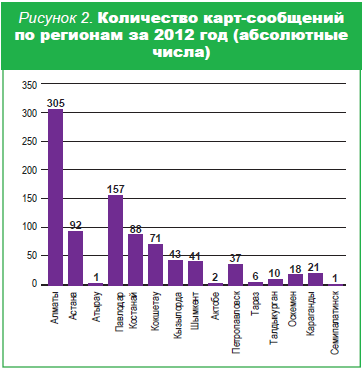
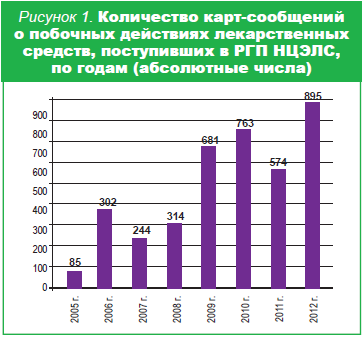 В настоящее время разработаны различные методы оценки эффективности и безопасности лекарственных препаратов c момента фармацевтической разработки до широкого применения в медицинской практике (спонтанные сообщения, клинические испытания, активный мониторинг стационаров, рецептурный мониторинг, случай-контроль, когортные исследования, мета-анализ и другие). Основным методом в работе практически всех служб мониторинга безопасности лекарственных средств во всех странах мира является метод спонтанных сообщений (жёлтые карты), в том числе и в нашей стране. «Желтая карта» – хорошо известная форма, которая заполняется врачом в случае возникновения какой-либо побочной реакции на препарат независимо от того, описан он в инструкции по применению или нет. Не только врач, но и больной, и его родственники должны сообщать о возникшей нежелательной реакции в группу мониторинга побочного действия лекарственных средств РГП на ПХВ «Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники» МЗ РК для изучения последним причинно-следственной связи возникновения побочной реакции. На основании анализа полученных сообщений министерством здравоохранения могут быть приняты соответствующие регуляторные меры для обеспечения наибольшей безопасности приема препаратов: внесение изменений и дополнений в инструкции по медицинскому применению препаратов, перевод лекарственных средств из безрецептурных в рецептурные. В ряде случаев принимаются решения о необходимости проведения дополнительных доклинических и клинических исследований, приостановке действия регистрационного удостоверения и даже отзыве препарата с фармацевтического рынка. Результаты мониторинга побочных действий лекарственных средств в нашей стране свидетельствуют об отсутствии тесного и эффективного сотрудничества между всеми партнёрами в области ФН (МЗ РК, медицинскими и фармацевтическими учреждениями, ассоциациями, СМИ, пациентами и др.). Количество и качество поступающих сообщений не всегда позволяют объективно оценить безопасность применения препаратов и принять соответствующие регуляторные меры. На рисунках 1,2 видно, что с каждым годом количество поступающих карт-сообщений увеличивается, но активность медицинских и фармацевтических работников в данном процессе остаётся низкой. Среди причин, побуждающих врачей не сообщать о побочных реакциях, наиболее распространены следующие: «Некогда, не встречали, страшно – вдруг накажут». В этой ситуации хочется еще раз призвать врачей к ответственности и напомнить о том, что тот или иной нежелательный эффект препарата может возникнуть и у других пациентов с ещё более тяжёлыми осложнениями, которые легче предупредить, чем бороться с ними.
В настоящее время разработаны различные методы оценки эффективности и безопасности лекарственных препаратов c момента фармацевтической разработки до широкого применения в медицинской практике (спонтанные сообщения, клинические испытания, активный мониторинг стационаров, рецептурный мониторинг, случай-контроль, когортные исследования, мета-анализ и другие). Основным методом в работе практически всех служб мониторинга безопасности лекарственных средств во всех странах мира является метод спонтанных сообщений (жёлтые карты), в том числе и в нашей стране. «Желтая карта» – хорошо известная форма, которая заполняется врачом в случае возникновения какой-либо побочной реакции на препарат независимо от того, описан он в инструкции по применению или нет. Не только врач, но и больной, и его родственники должны сообщать о возникшей нежелательной реакции в группу мониторинга побочного действия лекарственных средств РГП на ПХВ «Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники» МЗ РК для изучения последним причинно-следственной связи возникновения побочной реакции. На основании анализа полученных сообщений министерством здравоохранения могут быть приняты соответствующие регуляторные меры для обеспечения наибольшей безопасности приема препаратов: внесение изменений и дополнений в инструкции по медицинскому применению препаратов, перевод лекарственных средств из безрецептурных в рецептурные. В ряде случаев принимаются решения о необходимости проведения дополнительных доклинических и клинических исследований, приостановке действия регистрационного удостоверения и даже отзыве препарата с фармацевтического рынка. Результаты мониторинга побочных действий лекарственных средств в нашей стране свидетельствуют об отсутствии тесного и эффективного сотрудничества между всеми партнёрами в области ФН (МЗ РК, медицинскими и фармацевтическими учреждениями, ассоциациями, СМИ, пациентами и др.). Количество и качество поступающих сообщений не всегда позволяют объективно оценить безопасность применения препаратов и принять соответствующие регуляторные меры. На рисунках 1,2 видно, что с каждым годом количество поступающих карт-сообщений увеличивается, но активность медицинских и фармацевтических работников в данном процессе остаётся низкой. Среди причин, побуждающих врачей не сообщать о побочных реакциях, наиболее распространены следующие: «Некогда, не встречали, страшно – вдруг накажут». В этой ситуации хочется еще раз призвать врачей к ответственности и напомнить о том, что тот или иной нежелательный эффект препарата может возникнуть и у других пациентов с ещё более тяжёлыми осложнениями, которые легче предупредить, чем бороться с ними.